| |
|
|
|
|
|
|
国家市场监督管理总局 国家卫生健康委员会 国家中医药管理局
关于发布辅酶Q10等五种保健食品原料目录的公告
根据《中华人民共和国食品安全法》《保健食品原料目录与保健功能目录管理办法》等规定,国家市场监督管理总局会同国家卫生健康委员会、国家中医药管理局制定了辅酶Q10等五种保健食品原料目录,现予发布,自2021年3月1日起施行。
附件:
市场监管总局 卫生健康委 中医药局
2020年11月23日
【原文链接】http://gkml.samr.gov.cn/nsjg/tssps/202012/t20201201_324007.html
附件2
《保健食品原料目录 破壁灵芝孢子粉》
原料名称 | 每日用量 | 功效 | |||
名称 | 用量范围 | 适宜人群 | 不适宜人群 | 注意事项 | |
破壁灵芝孢子粉 | 1-4g | 免疫力低下者 | 少年儿童、孕妇及乳母 | 增强免疫力 | |
破壁灵芝孢子粉原料技术要求
【来源】
破壁灵芝孢子粉为多孔菌科真菌赤芝(Ganoderma lucidum (Leyss. ex Fr.) Karst.)、紫芝(Ganoderma sinense Zhao, Xu et Zhang)、松杉灵芝(Ganoderma tsugae)的干燥成熟孢子,经灭菌(辐照灭菌和湿热灭菌等灭菌方法),干燥,低温物理破壁,过筛制得。
【感官要求】
应符合表1规定。
表1 感官指标
项目 | 要求 |
色泽 | 棕褐色 |
滋味、气味 | 气微,味淡或微苦 |
状态 | 无结块,干燥疏松细腻粉末,无粘连,无沙粒感,无正常视力可见外来异物 |
【鉴别】
显微鉴别:粉末棕褐色,置显微镜下观察,孢壁多破碎,可见多数黄褐色的大小不等的微粒、孢子破碎程度不同的壳段或孢子破碎后里面的黄色至黄褐色的内容物,少见有未破壁的孢子,不得检出子实体、菌丝、淀粉粒等异物。
【理化指标】
应符合表2规定。
表2 理化指标
项目 | 指标 | 检验方法 |
破壁率% ≥ | 95 | 1 破壁率的测定 |
水分,% ≤ | 9.0 | GB 5009.3 |
总灰分,% ≤ | 3.0 | GB 5009.4 |
铅 (以Pb计), mg/kg ≤ | 2.0 | GB5009.12 |
砷 (以As计), mg/kg ≤ | 1 | GB/T 5009.11 |
汞 (以Hg计), mg/kg ≤ | 0.1 | GB/T 5009.17 |
镉nbsp; (以Cd计),mg/kg ≤ | 0.5 | GB5009.15 |
镍 (以Ni计), mg/kg ≤ | 1.0 | GB/T 5009.138 |
铬 (以Cr计), mg/kg ≤ | 2.0 | GB/T 5009.123 |
过氧化值(以灵芝孢子油计),g/100g ≤ | 0.20 | GB5009.227 |
1 破壁率的测定
1.1 仪器与设备
1.1.1 血球计数板:25个中格×16个小格或16个中格×25个小格。
1.1.2 电子分析天平:精度0.1mg。
1.1.3 超声波清洗器:功率≥45W。
1.1.4 光学显微镜:放大倍数≥200。
1.1.5 烘箱。
1.2 试剂和溶液
除非另有规定,本方法中所用试剂均为分析纯。
1.2.1 实验用水应符合GB/T6682规定的三级水规格。
1.2.2 吐温80。
1.2.3 蔗糖。
1.3 样品制备
分别取同一批次有代表性灵芝孢子粉和破壁灵芝孢子粉的样品各至少100g,分别充分混匀,置于密闭的容器内。
1.4 分析步骤
1.4.1 取适量同一批次的灵芝孢子粉A和破壁灵芝孢子粉B,于烘箱60℃下烘干5h。
1.4.2 准确称取经烘干的孢子粉A和破壁灵芝孢子粉B,其中mA=0.1000g,mB=0.1500g。
1.4.3 分别称取5.0g经过研磨后过100目筛的蔗糖粉末,分别与孢子粉A、B充分混合至色泽均一。用蒸馏水分别溶解上述样品,在样品溶液中加0.1mL吐温80,用蒸馏水定容到100mL的容量瓶中,并在室温超声震荡30min,使孢子充分分散。
1.4.4 将待测孢子悬液,用吸管吸取一滴置于盖玻片的边缘,使液体缓缓渗入,多余的液体用吸水纸吸取,进样完成后静置约30s,然后将血球计数板置于200倍及以上放大倍数的光学显微镜下进行观察计数。
1.4.5 使用25个中格×16个小格的计数板时,应计算出血球计数板4个角上与中央5个中格中含完整灵芝孢子的数目(即以80个小格为一个计数单位);当使用16个中格×25个小格的计数板时,应计算出血球计数板4个角上的4个中格中含完整灵芝孢子的数目(即以100个小格为一个计数单位)。如有部分孢子处于中格边线上,计数时应该仅统计位于中格四个边线的其中两个边线的孢子数,每个样品观察计数时应去掉离群较大的值,每个样品有效观察计数不少于3次,然后计算它们的平均数n。
1.5 结果计算
1.5.1 使用25个中格×16个小格的计数板时,每克孢子粉中含完整灵芝孢子数按式(1.1)计算:
![]() (1.1)
(1.1)
式中:
N——每克孢子粉含完整的灵芝孢子数,单位为个每克(个/g);
n——80个小方格内含完整灵芝孢子的总数,单位为个;
V——孢子稀释液的体积,单位为毫升(mL);
m——样品的质量,单位为克(g);
400——血球计数板的计数室内共有400个小方格;>
10000——血球计数板计数室的容积为0.1mm3,1mL相当于10000个血球计数板计数室的容积。
1.5.2 使用16个中格×25个小格的计数板时,每克孢子粉中含完整灵芝孢子数按式(1.2)计算:
![]() (1.2)
(1.2)
式中:
N——每克孢子粉含完整的灵芝孢子数,单位为个每克(个/g);
n——100个小方格内含完整灵芝孢子的总数,单位为个;
V——孢子稀释液的体积,单位为毫升(mL);
m——样品的质量,单位为克(g);
400——血球计数板的计数室内共有400个小方格;
10000——血球计数板计数室的容积为0.1 mm3,1mL相当于10000个血球计数板计数室的容积。
1.5.3 破壁率按式(1.3)计算:
![]() (1.3)
(1.3)
式中:
X——破壁灵芝孢子粉的破壁率,%;
NB——每克破壁灵芝孢子粉中含完整的灵芝孢子数,单位为个每克(个/g);
NA——每克灵芝孢子粉中含完整的灵芝孢子数,单位为个每克(个/g)。
【微生物指标】
应符合表3规定。
表3 微生物指标
项目 | 指标 | 检验方法 |
菌落总数,CFU/g ≤ | 30000 | GB 4789.2 |
霉菌和酵母,CFU/g ≤ | 50 | GB 4789.15 |
大肠菌群,MPN/g ≤ | 0.92 | GB 4789.3 MPN计数法 |
沙门氏菌 ≤ | 0/25g | GB 4789.4 |
金黄色葡萄球菌 ≤ | 0/25g | GB 4789.10 |
【标志性成分指标】
应符合表4规定。
表4 标志性成分指标
项目 | 指标 | 检验方法 |
多糖,% ≥ | 0.9(以无水葡萄糖(C6H12O6)计) | >2 多糖的测定 |
2 多糖的测定
2.1 试剂和材料
2.1.1 硫酸(分析纯)
2.1.2 葡萄糖(分析纯)
2.1.3 无水乙醇(分析纯)
2.1.4硫酸蒽酮溶液:精密称取蒽酮0.1g,加硫酸溶液100 mL使溶解,摇匀,置于棕色瓶中即得。
2.2 仪器和设备
2.2.1 分析天平(感量0.0001g)
2.2.2 分光光度计
2.2.3 玻璃回流装置
2.2.4 电热恒温水浴锅
2.2.5 容量瓶25mL,50mL容量瓶
2.2.6 各规格移液管
2.2.7 具塞试管25mL
2.2.8 滤纸(中速定性滤纸)。
2.3 标准曲线的制备
2.3.1 对照品溶液的制备
取无水葡萄糖对照品适量,精密称定加水制成每1mL含0.12mg的溶液,即得。
2.3.2 标准曲线绘制
精密量取对照品溶液0.2、0.4、0.6、0.8、1.0、1.2 mL,分别置于10mL的具塞试管中,各加水至2.0 mL,迅速精密加入硫酸蒽酮溶液6mL,立即摇匀,放置15min,立即置冰水浴中冷却15min,取出,以相应的试剂为空白,在625nm处测定吸光度,以吸光度为纵坐标,绘制标准曲线。
标准曲线图

2.4 供试品溶液的制备
取本品粉末约2g,精密称定,置圆底烧瓶中,加水60mL>,静1h,加热回流4h,趁热过滤,用少量热水洗涤滤器和滤渣,将滤纸和滤渣置圆底烧瓶中,加水60mL,加热回流3h,趁热过滤,合并滤液,置水浴锅上蒸干,残渣用水5mL溶解,边搅拌边缓慢加入乙醇>75mL">,摇匀,在4℃放置12h,离心,弃去上清液,沉淀物用热水溶解并转移至50mL,放冷,加水至刻度,摇匀取溶液适量,离心,精密量取上清液3mL,置25mL量瓶,加水至刻度,摇匀,即得。
2.5 测定
精密量取供试品溶液2mL>,置10mL具塞试管中,照标准曲线制备项下的方法,自“迅速精密加入硫酸蒽酮溶液6mL”起,同法操作,测定吸光度,从标准曲线上读出供试品溶液中无水葡萄糖的含量,计算即得。
2.6 结果计算
![]()
式中:
W-多糖的含量,%;
>c-从标准曲线上查的样品的多糖浓度,mg/mL;
m-样品质量,mg;
![]() 、
、![]() -表示稀释倍数。
-表示稀释倍数。
>50-水提醇沉后获得的沉淀物经热水溶解定容的体积数值
【储存】遮阴、密闭、阴凉处。
【产品的剂型】片剂、颗粒剂、硬胶囊、粉剂
——————————
附件3
《保健食品原料目录 螺旋藻》
原料名称 | 每日用量 | 功效 | |||
名称 | 用量范围 | 适宜人群 | 不适宜人群 | 注意事项 | |
螺旋藻 | 3-4g | 免疫力低下者 | 婴幼儿、孕妇及乳母、过敏体质人群 | 增强免疫力 | |
螺旋藻原料技术要求
【来源】
螺旋藻为钝顶螺旋藻(Arthrospira platensis)和极大螺旋藻(Arthrospira maxima)经人工培养、采收、清洗的藻泥,经过喷雾干燥,或者其他干燥方法并经杀菌获得的干粉。
【感官要求】
应符合表1规定。
表1 感官指标
项目 | 要求 |
色泽 | 蓝绿色至墨绿色 |
滋味、气味 | 无异味,略带藻腥味 |
状态 | 均匀干燥疏松粉末,无结块,无正常视力可见外来杂质 |
【鉴别】
取少量样品于水中,充分震荡搅拌使藻粉颗粒分散,显微镜视野中应呈分散、绿色的S形、L形、C形或螺旋形的藻丝体,不得有明显异物。
【理化指标】
应符合表2规定。
表2 理化指标
项目 | 指标 | 检验方法 |
水分,% ≤ | 7.0 | GB 5009.3第一法 |
总灰分,% ≤ | 7.0 | GB 5009.4 |
蛋白质,% ≥ | 55.0 | GB 5009.5 |
铅(以Pb计), mg/kg ≤ | 2.0 | GB 5009.12 |
砷(以As计), mg/kg ≤ | 1.0 | GB 5009.11 |
汞(以Hg计), mg/kg ≤ | 0.3 | GB 5009.17 |
镉(以Cd计), mg/kg ≤ | 0.2 | GB 5009.15 |
【微生物指标】
应符合表3规定。
表3 微生物指标
项目 | 指标 | 检验方法 | |||
菌落总数,CFU/g ≤ | 30000 | GB 4789.2 | |||
霉菌和酵母,CFU/g ≤ | 50 | GB 4789.15 | |||
大肠菌群,MPN/g ≤ | 0.92 | GB 4789.3 MPN计数法 | |||
沙门氏菌 ≤ | 0/25g | GB 4789.4 | |||
金黄色葡萄球菌 ≤ | 0/25g | GB 4789.10 | |||
副溶血性弧菌,MPN/g | 采样量为25g | GB/T 4789.7 | |||
n | c | m | M | ||
5 | 1 | 100 MPN/g | 1000 MPN/g | ||
注:n为同一批次产品应采集的样品件数;c为最大可允许超出m值的样品数;m为致病菌指标可接受水平的限量值;M为致病菌指标的最高安全限量值。
【标志性成分指标】
应符合表4规定。
表4 标志性成分指标
项目 | 指标 | 检验方法 |
β-胡萝卜素,g/kg ≥ | 0.20 | 1 β-胡萝卜素的测定 |
藻蓝蛋白,% ≥ | 5.00 | 2 藻蓝蛋白的测定 |
1 β-胡萝卜素的测定
1.1 试剂和材料
1.1.1 氢氧化钾溶液:称固体氢氧化钾500g,加入500mL水溶解。临用前配制。
1.1.2 无水硫酸钠(Na2SO4),分析纯
1.1.3 抗坏血酸(C6H8O6),分析纯
1.1.4 石油醚:沸程30℃~60℃,分析纯
1.1.5 甲醇(CH4O),色谱纯
1.1.6 乙腈(C2H3N),色谱纯
1.1.7 甲基叔丁基醚[CH3OC(CH3)3],色谱纯
1.1.8 二氯甲烷(CH2Cl2),色谱纯
1.1.9 无水乙醇(C2H6O),优级纯
1.1.10 水,符合GB/T6682规定的一级水
1.1.11 碘溶液(I2):0.5 mol/L浓度
1.1.12 2,6-二叔丁基-4-甲基苯酚(C15H24O,BHT)
1.2 仪器和设备
1.2.1 匀浆机
1.2.2 高速粉碎机
1.2.3 恒温振荡水浴箱(控温精度±1℃)
1.2.4 旋转蒸发器
1.2.5 氮吹仪
1.2.6 紫外-可见光分光光度计
1.2.7 高效液相色谱仪(带紫外检测器)
1.3 对照品溶液制备
1.3.1 β-胡萝卜素标准储备液(500μg/mL)
准确称取 β-胡萝卜素标准品25mg(精确到0.1mg),加入0.125gBHT,用二氯甲烷溶解,转移至50mL棕色容量瓶中定容至刻度。
1.3.2 β-胡萝卜素标准中间液(100 μg/mL)
从 β-胡萝卜素标准储备液中准确移取10.0 mL溶液于50mL棕色容量瓶中,用二氯甲烷定容至刻度。
1.3.3 β-胡萝卜素标准工作液
从 β-胡萝卜素标准中间液中分别准确移取0.50 mL、1.00 mL、2.00 mL、3.00 mL、4.00 mL、10.00 mL溶液至6个100 mL棕色容量瓶。 用二氯甲烷定容至刻度,得到浓度为0.5 μg/mL、1.0 μg/mL、2.0 μg/mL、3.0 μg/mL、4.0 μg/mL、10 μg/mL的系列标准工作液。
1.3.4 碘乙醇溶液(0.05 mol/L)
吸取5 mL碘溶液,用乙醇稀释至50 mL,混匀。
1.3.5 异构化β-胡萝卜素溶液
取10 mL β-胡萝卜素标准储备液于烧杯中,加入20 μL碘乙醇溶液,摇匀后于日光下或距离40 W日光灯30 cm处照射15 min,用二氯甲烷稀释至50 mL。摇匀后过0.45 μm滤膜,备HPLC色谱分析用。
1.4 供试品溶液制备
1.4.1 预处理
精确称取1g~5g (精确至0.001g)螺旋藻粉,转至250mL锥形瓶中,加入1g抗坏血酸、75mL无水乙醇,于60℃±1℃水浴振荡30min。
1.4.2 皂化
加入25mL氢氧化钾溶液,盖上瓶塞。置于已预热至53℃±2℃恒温振荡水浴箱中,皂化30min。取出,静置,冷却到室温。
1.4.3 试样萃取
将皂化液转入500mL分液漏斗中,加入100mL石油醚,轻轻摇动,排气,盖好瓶塞,室温下振荡,10min后静置分层,将水相转入另一分液漏斗中按上述方法进行第二次提取。合并有机相,用水洗至近中性。弃水相,有机相通过无水硫酸钠过滤脱水。滤液收入500mL蒸发瓶中,于旋转蒸发器上40℃±2℃减压浓缩,近干。用氮气吹干,用移液管准确加入5.0mL二氯甲烷,盖上瓶塞,充分溶解提取物。经0.45 μm膜过滤后,弃出初始约1mL滤液后收集至进样瓶中,备用。
1.5 色谱条件
a) 色谱柱:C30柱,柱长150mm,内径4.6mm,粒径5μm,或等效柱;
b) 流动相:A相:甲醇:乙腈:水=73.5:24.5:2;
B相:甲基叔丁基醚;
表5 梯度程序
时间/min | 0 | 15 | 18 | 19 | 20 | 22 |
A% | 100 | 59 | 20 | 20 | 0 | 100 |
B% | 0 | 41 | 80 | 80 | 100 | 0 |
c) 流速:1.0mL/min;
d) 检测波长:450nm;
e) 柱温:30 ℃±1 ℃;
f) 进样体积:20μL。
1.6 测定
在相同色谱条件下,将待测液注入液相色谱仪中,以保留时间定性,根据峰面积采用外标法定量,β-胡萝卜素根据全反式β-胡萝卜素响应因子进行计算。
1.7 全反式β-胡萝卜素色谱纯度的计算
1.7.1 β-胡萝卜素异构体保留时间的确认
分别取β-胡萝卜素标准中间液(100 μg/mL)和异构化β-胡萝卜素溶液,按照色谱条件注入HPLC仪进行色谱分析。根据β-胡萝卜素标准中间液的色谱图确认全反式β-胡萝卜素的保留时间;对比β-胡萝卜素标准中间液和异构化β-胡萝卜素溶液色谱图中各峰面积变化,以及与全反式β-胡萝卜素的位置关系确认顺式β-胡萝卜素异构体的保留时间:全反式β-胡萝卜素前较大的色谱峰为13-顺式-β-胡萝卜素,紧邻全反式β-胡萝卜素后较大的色谱峰为9-顺式-β-胡萝卜素,13-顺式-β-胡萝卜素前是15-顺式-β-胡萝卜素,另外可能还有其他较小的顺式结构色谱峰,色谱图见图。
1.7.2 全反式β反胡萝卜素标准液色谱纯度的计算
取β-胡萝卜素标准工作液(3 μg/mL),按照色谱条件进行HPLC分析,重复进样6次。计算全反式β-胡萝卜素色谱峰的峰面积、全反式与上述各顺式结构的峰面积总和,全反式β-胡萝卜素色谱纯度(CP)按公式计算。
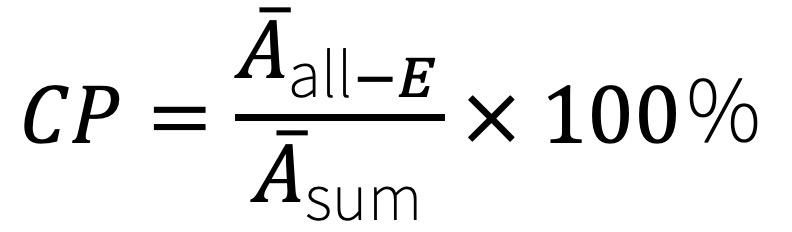
CP———全反式β-胡萝卜素色谱纯度,%;
Ᾱall-E>———全反式β-胡萝卜素色谱峰峰面积平均值,单位为峰面积(AU);
Ᾱsum———全反式 β-胡萝卜素及各顺式结构峰面积总和平均值,单位为峰面积(AU)。
1.8 结果计算
计算全反式 β-胡萝卜素响应因子
将β-胡萝卜素混合标准工作液注入HPLC仪中(色谱图见图1),根据保留时间定性,测定β-胡萝卜素各异构体峰面积。
β-胡萝卜素根据标准工作液标定浓度、全反式β-胡萝卜素6次测定峰面积平均值、全反式β-胡萝卜素色谱纯度(CP),按公式计算全反式β-胡萝卜素响应因子。

式中:
RF ———全反式β-胡萝卜素响应因子,单位为峰面积毫升每微克(AU·mL/μg);
Ᾱall-E ———全反式β-胡萝卜素标准工作液色谱峰峰面积平均值,单位为峰面积(AU);
ρ ———β-胡萝卜素标准工作液标定浓度,单位为微克每毫升(μg/mL);
CP ———全反式>β-胡萝卜素的色谱纯度,%。
>试样中β-胡萝卜素含量按下公式计算:
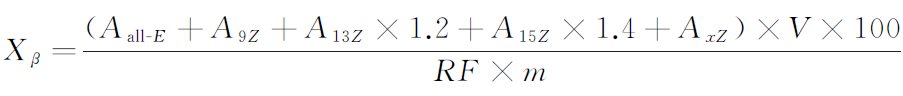
式中:
Xβ ———试样中β-胡萝卜素的含量,单位为微克每百克(μg/100g);
Aall-E ———试样待测液中全反式β-胡萝卜素峰面积,单位为峰面积(AU);
A9Z ———试样待测液中9-顺式-β-胡萝卜素的峰面积,单位为峰面积(AU);
A13Z ———试样待测液中13-顺式-β-胡萝卜素的峰面积,单位为峰面积(AU);
1.2 ———13-顺式-β-胡萝卜素的相对校正因子;
A15Z ———试样待测液中15-顺式-β-胡萝卜素的峰面积,单位为峰面积(AU);
1.4 ———15-顺式-β-胡萝卜素的相对校正因子;
AxZ ———试样待测液中其他顺式β-胡萝卜素的峰面积,单位为峰面积(AU);
V ———试样液定容体积,单位为毫升(mL);
100 ———将结果表示为微克每百克(μg/100g)的系数;
RF ———全反式β-胡萝卜素响应因子,单位为峰面积毫升每微克(AU·mL/μg);
m ———试样质量,单位为克(g)。
注1:由于β-胡萝卜素各异构体百分吸光系数不同(见附录D),所以在β-胡萝卜素计算过程中,需采用相对校正因子对结果进行校正。
注2:如果试样中其他顺式β-胡萝卜素含量较低,可不进行计算。
1.9 色谱图
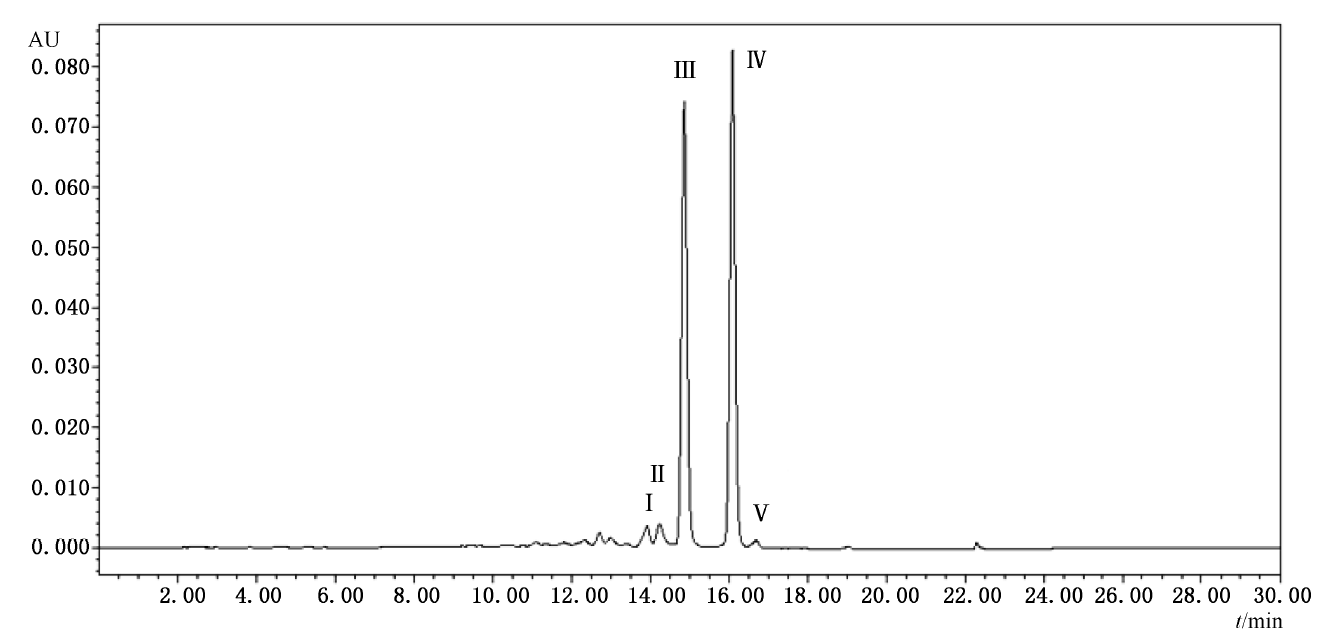
图1 β-胡萝卜素检测色谱图
说明:
Ⅰ——15-顺式-β-胡萝卜素;
Ⅱ——13-顺式-β-胡萝卜素;
Ⅲ——全反式α-胡萝卜素;
Ⅳ——>全反式β-胡萝卜素;
Ⅴ——9-顺式-β-胡萝卜素。
2 藻蓝蛋白的测定
2.1 试剂
磷酸盐缓冲溶液:将0.1 mol/L磷酸二氢钾溶液与0.1 mol/L磷酸氢二钾溶液(45+55V/V) 混合,溶液pH值为7.0。
2.2 仪器和设备
2.2.1 分光光度计
2.2.2 超声波振荡器
2.2.3 离心机(3000 r/min)
2.2.4 低温冰箱(-20 ℃)
2.2.5 离心管(50 mL)。
2.3 供试品溶液制备
称取试样0.25-0.5g(精确至0.0001g)。用缓冲液(2.1项)溶解,超声振荡5 min.定容于250 mL容量瓶中,摇匀。将溶液全部转入250 mL广口塑料瓶,置于-20℃冰箱内冷冻12h(或放置过夜)。取出解冻,摇匀。
2.4 测定
取部分溶液于离心管中,在3000r/min转速下离心15min取上层清液.1 cm比色皿,在分光光度计上分别测定620 nm、652 nm、562 nm处的吸光度,用缓冲液(2.1项)做空白。
2.5 结果计算
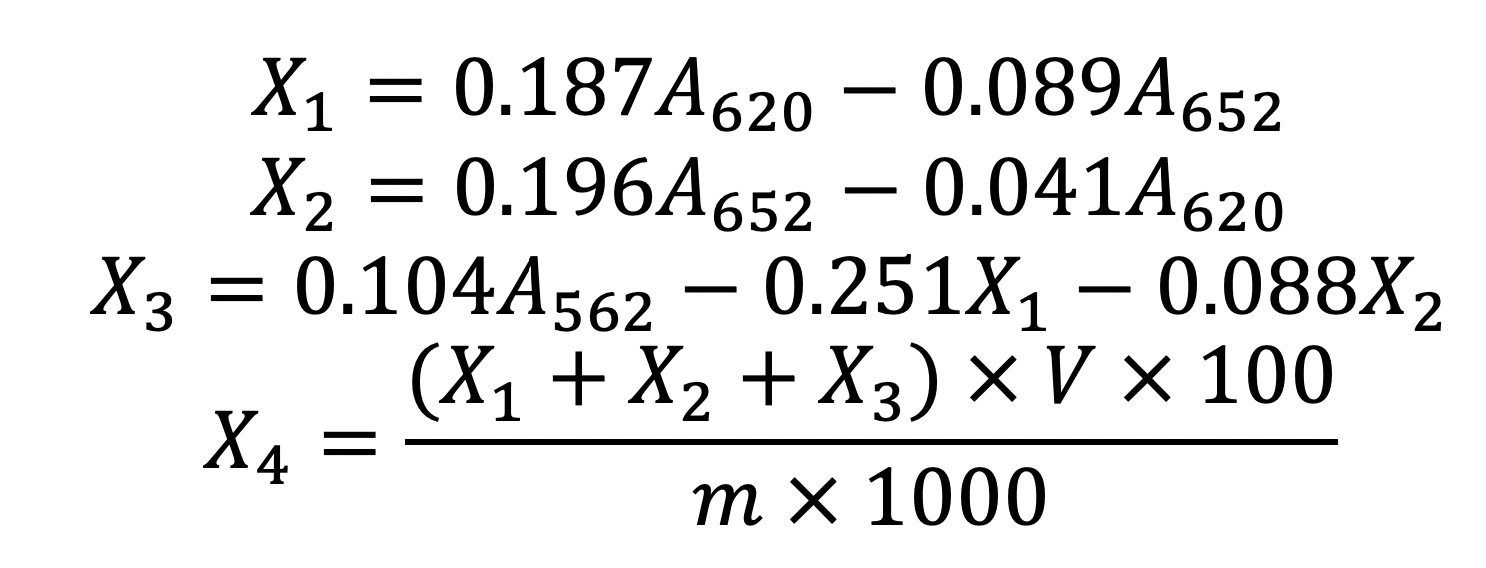
X1——测试液中藻蓝素的含量,单位为毫克每毫升(mg/mL);
X2——测试液中异藻蓝素的含量,单位为毫克每毫升(mg/mL);
X3——测试液中藻红素的含量,单位为毫克每毫升(mg/mL);
A——相应波长处(620nm,652nm,562nm)测得吸光值;
X4——试样中藻蓝蛋白的质量分数,单位为克每100克(g/100g);
V——样品定容体积,单位为毫升(mL)。
m——试样质量,单位为克(g)。
测定结果取平行试验结果的算术平均值,保留小数点后第二位。
平行试验允许误差(相对)不大于4%。
注2 整个操作过程须注意避光,分光光度测定应在15 min 内完成。
【储存】包装应密封、牢固、防潮、不易破损,贮藏在遮荫、干燥、通风的库房内
【产品的剂型】片剂、颗粒剂、硬胶囊
——————————











 沪ICP备11012790号
沪ICP备11012790号 沪公网安备31010702005226号
沪公网安备31010702005226号 营业执照
营业执照